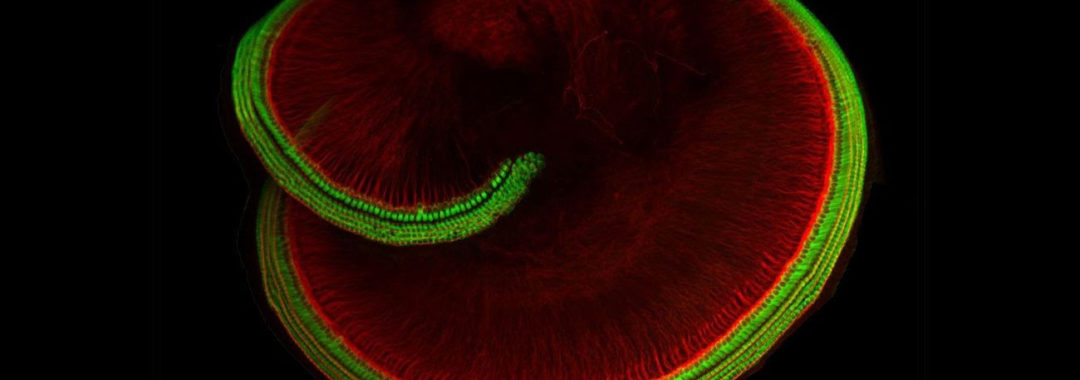
La cochlée, un petit os en forme de coquille d’escargot, est tapissé de cellules ciliées, indispensables pour l’audition.
Seize mille cellules sensorielles pour l’oreille interne, contre une centaine de millions pour la rétine. Rares et difficiles d’accès, les cellules impliquées dans l’audition, ou cellules ciliées, sont encore mal connues. Or deux avancées importantes ont été réalisées récemment. L’équipe de Jeffrey Holt, de l’université Harvard, aux États-Unis, a identifié la protéine qui, dans ces cellules, participe à convertir le son en signal électrique. Par ailleurs, François Lallemend, de l’institut Karolinska, à Stockholm, et ses collègues ont décrit de nouvelles catégories de neurones qui contribuent à la conduction de ce signal au cerveau.
« On connaissait le mécanisme de la conversion du son en signal électrique depuis les années 1970 : les ondes acoustiques perturbent les stéréocils des cellules ciliées de l’oreille interne. Des canaux s’ouvrent à la surface de ces cellules pour laisser des ions potassium et calcium pénétrer dans la cellule. Il ne manquait que l’identification de la protéine qui constitue le canal », rappelle Jean-Luc Puel, chercheur en neurosciences à l’Inserm à Montpellier, qui n’a pas participé à ces travaux. Une molécule, nommée TMC1 et découverte en 2002, pourrait jouer ce rôle. En 2011, l’équipe de l’université Harvard avait montré qu’elle participait au système auditif sans pouvoir préciser comment.
A lire aussi : Un système auditif précis et efficace
En combinant des approches biochimiques et bioinformatiques, la même équipe a maintenant étudié la structure que prennent des dimères de TMC1, c’est-à-dire des paires de molécules de TMC1, pour former un canal. Les chercheurs ont ensuite induit des mutations sur certains acides aminés de TMC1 dans des cellules ciliées de souris afin de déterminer comment les altérations dans la structure de la molécule perturbaient le flux d’ions entrant dans les cellules. Sur les substitutions de 17 acides aminés testés, 11 perturbent le flux d’ions, cinq le réduisent de 80 % et une en particulier le bloque totalement, ce qui permet aux chercheurs d’affirmer que TMC1 constitue bien le canal d’entrée ionique, sans toutefois pouvoir exclure le rôle d’autres protéines complémentaires. Point intéressant, des mutations de cette protéine ont été identifiées dans certains types de surdité, laissant entrevoir des thérapies ciblées.
L’équipe de François Lallemend s’est intéressée à l’étape suivante : la transmission du signal vers les relais centraux auditifs par les neurones du ganglion spiral. Les chercheurs savaient déjà que la majorité de ces neurones, dits de type 1, présentent des caractéristiques diverses : des seuils d’activation à des intensités sonores basse, moyenne ou haute et une activité spontanée plus ou moins élevée. Toute la question était de savoir si ce type de neurones était capable de s’adapter à différents signaux sonores ou s’il regroupait en réalité plusieurs types de neurones aux caractéristiques différentes.
A lire aussi : Le fléau des pertes auditives cachées
L’équipe de François Lallemend de l’institut Karolinska de Stockholm vient de montrer, en même temps que deux autres équipes dans le monde, que les neurones de type 1 peuvent être différenciés en au moins trois types cellulaires. Pour cela, les chercheurs ont utilisé une technique de séquençage du transcriptome dans des cellules individuelles (c’est-à-dire de l’ensemble des ARN transcrits par la cellule à partir du génome). « Ce séquençage massif nous a permis d’identifier des signatures de plusieurs centaines de gènes », détaille François Lallemend. Les chercheurs montrent ainsi qu’il y existe au moins trois types de neurones avec une activité de transcription différente.
Ces différentes populations sont présentes dès la naissance chez la souris, avant même une quelconque activité neuronale. « En revanche, leur maturation nécessiterait une activité neuronale liée par exemple à l’exposition au son et impliquerait notamment la répression de l’expression de gènes », ajoute le chercheur. De futures études permettront de préciser les fonctions de ces différents types de neurones. L’équipe envisage aussi d’appliquer la même méthode aux neurones des relais centraux. « Disposer de marqueurs est fondamental pour comprendre la physiopathologie de ces neurones : les neurones avec un seuil haut sont plus fragiles en cas de trauma sonore et peuvent être perdus lors du vieillissement. Il sera aussi intéressant d’identifier les fibres concernées dans des pathologies comme les acouphènes ou l’hyperacousie », estime Jean-Luc Puel.